- परमाणु किसे कहते हैं | Parmanu Kise Kahate Hain
- परमाणु क्या है | Parmanu Kya Hai
- परमाणु की परिभाषा | Parmanu Ki Paribhasha
- विभिन्न परमाणु मॉडल | Variety of Atomic Models
- बोर का परमाणु मॉडल | Bor Ka Parmanu Model
- परमाणु संख्या, परमाणु संख्या किसे कहते हैं | Parmanu Sankhya, Parmanu Sankhya Kya Hai
- 1 से 40 तक परमाणु क्रमांक, परमाणु क्रमांक 1 से 30 तक | Parmanu Kramank 1 to 50
- परमाणु ऊर्जा क्या है | Parmanu Urja Kya Hai
- FAQ | परमाणु | Parmanu
परमाणु किसे कहते हैं | Parmanu Kise Kahate Hain
तत्व का वह छोटे से छोटा कण है जो रासायनिक अभिक्रिया में भाग लेता है। ऐसे तत्व को परमाणु कहते है। अधिकांश तत्वों के परमाणु अत्यंन्तं अभिक्रियाशील होते हैं और मुक्त अवस्था में (अकेले परमाणु के रूप में) नहीं पाये जाते हैं। परमाणुओं के उतने ही प्रकार होते हैं, जितने कि तत्व के हैं।
परमाणु का आकार परमाणु अत्यन्त छोटे होते हैं तथा परमाणु की त्रिज्या को नैनोमीटर (nm) मापा जाता है। 10 ° m = 1nm 1m = 10 ° nm
परमाणु बहुत छोटे आकार के होते हैं; इसलिए उनकी व्यवहार और संरचना जानने के लिए किसी बड़ी संख्या में प्रयोग किए जाते है। इन प्रयोगों के परिणामों से हम एक परमाणु का एक काल्पनिक मॉडल बनाने का प्रयास किया जा सकता हैं जो सच्चे परमाणु की तरह ही व्यवहार करता है। अणु के सहसंयोजक (रासायनिक) बंधों द्वारा एक साथ बंधे एक या एक से अधिक परमाणुओं से बने होते हैं।
परमाणुओं को किसी वृत्त वाली आकृतियों के द्वारा ही दर्शाया जाता है, ओर जिनमें से प्रत्येक वृत के केंद्र में एक नाभिक जरूर होता है (जिसमें प्रोटॉन और न्यूट्रॉन पाए जाते हैं), ओर एक या एक से अधिक संकेंद्रित वृत्तों से घिरे हुए होते हैं ओर जो ‘शेल‘ या ‘स्तर‘ का प्रतिनिधित्व भी करते हैं। जिसमें परमाणु के नाभिक के आसपास के इलेक्ट्रॉन होते हैं। स्थित हैं और प्रत्येक स्तर पर इलेक्ट्रॉन को इंगित करने वाले चिह्न हैं। अणु सबसे छोटी चीज है जिसे एक ही पदार्थ के शेष रहते हुए विभाजित किया जा सकता है। यह दो या दो से अधिक परमाणुओं से बना होता है जो रासायनिक बंधन से बंधे होते हैं।
परमाणु क्या है | Parmanu Kya Hai
किसी पदार्थ का वह छोटा-से-छोटा कण जो किसी रासायनिक अभिक्रिया में भाग ले सके अथवा रासायनिक अभिक्रिया द्वारा अलग किया जा सके, उस कण को परमाणु (Atom) कहते हैं।
उदाहरण : हाइड्रोजन (H), नियॉन (Ne), आर्गन (Ar), लोहा (Fe), कैल्शियम (Ca).
परमाणु विभाज्य है और यह आवेशित कणों से मिलकर बना है। यह प्रकृति में स्वतंत्र अवस्था में उपस्थित नहीं रहता है, यह तीन मूल कणों से मिलकर बना होता है, जिसमें से एक प्रोटॉन, दूसरा न्यूट्रॉन तथा तीसरा इलेक्ट्रॉन होता है। प्रोटॉन व न्यूट्रॉन परमाणु के नाभिक में उपस्थित रहता है और इलेक्ट्रॉन परमाणु की कक्षाओं में होता है।
न्यूट्रॉन पर कोई भी आवेश नहीं होता है, अर्थात् यह आवेशहीन होता है। प्रोटॉन पर + 1.6 × 10-” कूलॉम का आवेश होता है और इलेक्ट्रॉन पर 1.6 x 10 -19 कूलॉम का आवेश होता है।
परमाणु की परिभाषा | Parmanu Ki Paribhasha
परमाणु ( Atom ) नाभिक में प्रोटॉन और न्यूट्रॉन से मिलकर बने हुवे होते हैं, ‘परमाणु‘ शब्द ग्रीक शब्द ‘ए-टोमियो‘ (अर्थ – अविभाज्य) से बना है। जो साथ में ही अन्य कई कणों के एक चिड़ियाघर के साथ जो बनाया जा सकता है। यदि हम इलेक्ट्रॉनों के एक बादल से घिरे परमाणु को पर्याप्त ऊर्जा से लागू करते हैं। तो यह स्पष्टीकरण ही हमें बताता है कि एक परमाणु किससे मिलकर बना है लेकिन वास्तव में परमाणु क्या नहीं है, यह क्या दर्शाता है? एक परमाणु और अधिकांश परमाणु अरबों वर्षों में इतने अविश्वसनीय रूप से स्थिर क्यों हैं, कभी भी खराब नहीं होते हैं या ऊर्जा से बाहर नहीं निकलते हैं।
परमाणु किसी भी तत्व के सूक्ष्मतम (यानी सबसे छोटे ) कण जिनसे अणु बनते हैं तथा जो रासायनिक अभिक्रियाओं (chemical reactions) में बिना अपघटित हुए भाग लेते हैं, उन्हें परमाणु (atom) कहा जाता हैं । कोई भी परमाणु रासायनिक रूप से अभाज्य होते हैं । लेकिन परमाणुओं को असाधारण भौतिक विधियों द्वारा उनके घटक कणों में विभाजित किया जा सकता है । परमाणुओं का आकार (size) अति सूक्ष्म और भार (atomic weight) बहुत ही कम होता है ।
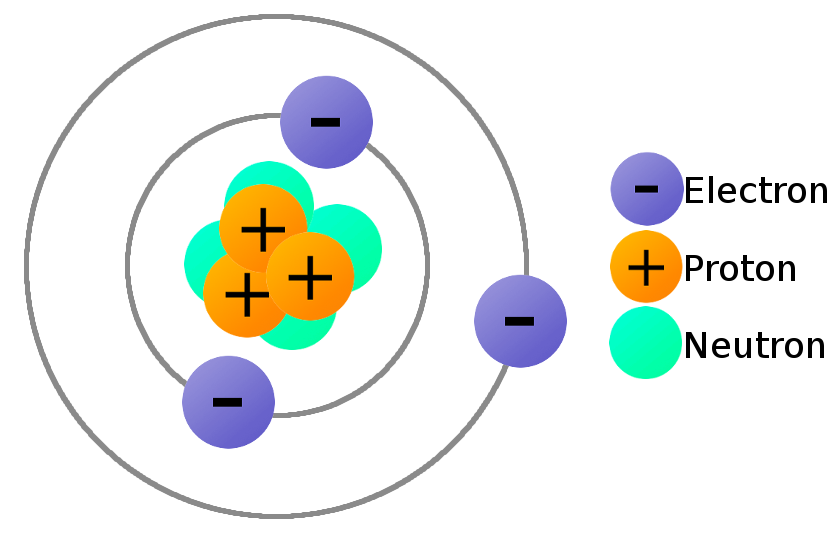
अगर साधारण से शब्दों में आपको समझाऊ तो यह पदार्थ का ऐसा अति सूक्ष्म कण जो अविभाज्य हो (जैसे—डाल्टन का परमाणु सिद्धांत भी अब नई–नई खोजों की परतों में दब गया है) ।
परमाणु तीन कणो से मिल कर बनते है –
– इलेक्ट्रान
– प्रोटोन
– न्यूट्रॉन
आपको जान कर बहुत ख़ुशी होगी कि परमाणु की खोज जॉन डाल्टन ने की थी और जॉन डाल्टन ने साल 1804 में परमाणु सिद्धांत प्रतिपादित किया था। परमाणु ब्रह्मांड में सभी मामलों के लिए बुनियादी निर्माण खंड है।
परमाणु अत्यंत छोटे होते हैं और कुछ छोटे कणों से बने होते हैं। परमाणु बनाने वाले मूल कण इलेक्ट्रॉन, प्रोटॉन और न्यूट्रॉन होते हैं। पदार्थ बनाने के लिए परमाणु अन्य परमाणुओं के साथ मिलकर फिट होते हैं।
विभिन्न परमाणु मॉडल | Variety of Atomic Models
परमाणु किसे कहते हैं और उसकी संरचना को समझाने के लिए वैज्ञानिकों द्वारा विभिन्न मॉडल दिए गए। Atomic Structure के बारे में नीचे विस्तार से दिया गया है-
रदरफोर्ड का परमाणु मॉडल | Rutherford Ka Parmanu Model, Ratherford Ka Parmanu Model
रदरफोर्ड के मॉडल के अनुसार परमाणु एक सौरमंडल की तरह है जिसमें नाभिक सूर्य की भांति बताया गया और इलेक्ट्रॉन, सूर्य के चारों ओर गति कर रहे ग्रहों की तरह बताया। परमाणु का नाम की मॉडल देने के लिए रदरफोर्ड ने अल्फा कण प्रकीर्णन का प्रयोग किया था, जिसमे इन्होंने गोल्ड की पतली पन्नी पर अल्फा कण की बौछार की थी। परमाणु का यह मॉडल भी कुछ खास नहीं चला और रिजेक्ट कर दिया गया क्योंकि यह परमाणु के स्थायित्व की व्याख्या नहीं कर पाया।
सन् 1911 में, इंग्लिश भौतिकविद् अर्नेस्ट रदरफोर्ड ने किसी परमाणु में दो मूलभूत कणों इलेक्ट्रॉन तथा प्रोटॉन की स्थिति ज्ञात करने के लिए α – कण प्रकीर्णन प्रयोग ( α -particle scattering experiment) किया।
इस प्रयोग के अन्तर्गत उन्होंने रेडियोऐक्टिव पदार्थ, जैसे— रेडियम को लेड के ब्लॉक के भीतर रखकर प्राप्त ऐल्फा-कणों को एक बारीक लेड की बनी स्लिट से गुजारकर इन्हें पुंज के रूप में प्राप्त किया। इस पुंज को उन्होंने एक भारी धातु; जैसे—गोल्ड की अत्यन्त पतली पन्नी (foil) (100 नैनोमीटर मोटाई) पर डाला।
इससे ये ऐल्फा-कण प्रकीर्णित हो गए, इनकी दिशा ज्ञात करने के लिए उसने जिंक सल्फाइड के लेप किए पर्दे का प्रयोग किया क्योंकि जब कण उससे टकराता है तो यह प्रतिदीप्ति उत्पन्न करता है और उसने देखा कि बहुत से ऐल्फा-कण – पन्नी से पार होकर पीछे लगे जिंक सल्फाइड (ZnS) के पर्दे के मध्य कई स्थानों पर दीप्ति प्रकाश (चमक) उत्पन्न होती है। इस प्रयोग ने इन मूलभूत कणों की परमाणु में स्थिति के निर्धारण में बहुत सहायता प्रदान की। इस प्रयोग को चित्र -‘2.8’ द्वारा दर्शाया गया है।
इस प्रयोग द्वारा रदरफोर्ड ने निम्नलिखित प्रेक्षण प्राप्त किए –
(1) अधिकांश अल्फा कण सोने की पत्ती से विक्षेपित हुए बिना निकल गए ।
(2) बहुत कम अल्फा कण छोटे कोण से विक्षेपित हुए।
(3) बहुत ही थोड़े कण (20000 में से 1) पीछे की ओर लौटे अर्थात् लगभग 180° के कोण से उनका विक्षेपण हुआ
रदरफोर्ड ने कई प्रयोग करने के पश्चात् निम्नलिखित निष्कर्ष निकाले –
(i) परमाणु के अंदर अधिकांश स्थान रिक्त होता है, क्योंकि अधिकांश अल्फा कण सोने की पन्नी को पार कर जाते हैं।
(ii) कुछ ही धनावेशित α कण विक्षेपित होते हैं। यह विक्षेपण अवश्य ही अत्यधिक प्रतिकर्षण बल (repulsive force) के कारण होगा। इससे यह पता चलता है कि थॉमसन के विचार के विपरीत परमाणु के अंदर धनावेश समान रूप से बँटा हुआ नहीं है। धनावेश बहुत कम आयतन के अंदर संकेंद्रित होना चाहिए, जिससे धनावेशित अल्फा कणों का प्रतिकर्षण और विक्षेपण हुआ हो।
(iii) रदरफोर्ड ने गणना करके दिखाया कि नाभिक का आयतन, परमाणु के कुल आयतन की तुलना में अत्यंत कम (नगण्य) होता है। माणु की त्रिज्या लगभग 10-10m होती है, जबकि नाभिक की त्रिज्या लगभग 10-15m होती है । आकार के इस अंतर का अंदाज इस बात से लगाया जा सकता है कि यदि नाभिक को क्रिकेट की गेंद जितना माना जाए, तो परमाणु की त्रिज्या लगभग 5km होगी।
उपरोक्त प्रेक्षणों और परिणामों के आधार पर रदरफोर्ड परमाणु का नाभिकीय मॉडल या रदरफोर्ड का परमाणु मॉडल प्रस्तुत किया। इस मॉडल के अनुसार –
रदरफोर्ड का परमाणु मॉडल
(i) परमाणु का धनावेश तथा अधिकांश द्रव्यमान एक अति अल्प क्षेत्र में केंद्रित होता है। परमाणु के इस अति अल्प भाग को रदरफोर्ड ने ‘नाभिक‘ कहा।
(ii) नाभिक के चारों ओर इलेक्ट्रॉन वृत्ताकार पथों, जिन्हें कक्षा (orbit) कहा जाता है, में बहुत तेजी से घूमते हैं। अतः रदरफोर्ड का परमाणु मॉडल सौरमंडल से मिलता-जुलता है, जिसमें सूर्य नाभिक के समान होता है और ग्रह गतिमान इलेक्ट्रॉन के समान होते हैं।
(iii) इलेक्ट्रॉन और नाभिक आपस में आकर्षण के स्थिर वैद्युत् बलों के द्वारा बँधे रहते हैं।
रदरफोर्ड परमाणु मॉडल की कमियाँ
ऋणावेशित कण (electron) नाभिक के चारों ओर निरंतर वृताकार पथ में परिक्रमा करते रहते हैं, किंतु उन्होंने यह स्पष्ट नहीं किया कि ये ऋणावेशित कण (electron) अनंत समय तक अपनी ऊर्जा संरक्षण कैसे करेंगे, क्योंकि निरंतर गति करने वाले किसी भी कण की ऊर्जा में कमी होगी और अंततः ऊर्जा विहीन होकर वह नाभिक में गिर जाएगा और परमाणु (atom) समाप्त हो जाएगा।
बोर का परमाणु मॉडल | Bor Ka Parmanu Model
सन 1915 में वैज्ञानिक बिहार ने एक परमाणु मॉडल प्रस्तुत किया। इस मॉडल के अनुसार गौहर ने बताया कि इलेक्ट्रॉन परमाणु के अंदर एक निश्चित ऊर्जा की कक्षा में ही गति करते हैं। परंतु बाहर का परमाणु मॉडल एकल इलेक्ट्रॉन स्पीशीज के लिए ही वैध था। जैसे की हाइड्रोजन।
बोर का पूरा नाम था- नील्स हेनरिक डेविड बोर है। इनका जन्म 1885 को डेनमार्क में हुआ। सन् 1913 में बोर द्वारा परमाणु मॉडल पेश किया गया। नील्स बोर द्वारा रदरफोर्ड के परमाणु मॉडल में कुछ तथ्यों की कमियों का अंदाजा लगाया गया तथा प्लांक के क्वाण्टम सिद्धांत की मदद लेते हुए बोर ने अपना एक मॉडल बनाया किया। यह मॉडल नील्स बोर द्वारा परमाणु के सम्बन्ध में बनाया गया था। इसे रदरफोर्ड-बोर मॉडल भी कहते है, क्योंकि इसका निर्माण रदरफोर्ड के परमाणु मॉडल में कुछ स्थितियों में सुधार व नवीनीकरण करके किया गया था, अतः काफी हद तक रदरफोर्ड के मॉडल के समान था।
बोर के इस मॉडल के अनुसार यह बात सिद्ध की गयी थी कि इलेक्ट्रॉन द्वारा नाभिक के बाहरी ओर लगातार तेज गति से चक्कर लगाये जाते हैं। इसके लिए इलेक्ट्रॉन को ऊर्जा या बल की जरूरत पड़ती है। इसे अपकेंद्रिय बल कहा जाता हैं। जब विद्युत के ऋण आवेश युक्त इलेक्ट्रॉन का नाभिक के चक्कर लगाने से इसमें मौजूद धन आवेश वाले प्रोटॉन के कारण इनके मध्य आकर्षण बल उत्पन्न होता है। यह आकर्षण बल ही इलेक्ट्रॉन को अपकेंद्रिय बल देने में मदद करता है। इसके कारण ही इनमे गति करने की ऊर्जा बनी रहती है। अतः बोर के परमाणु मॉडल के परिणामस्वरूप यह बात स्पष्ट होती है कि इलेक्ट्रॉन को अपकेंद्रिय बल नाभिक में स्थित प्रोटॉन के होने से प्राप्त होता है।
बोर ने अपने मॉडल में इस बात को बी सिद्ध किया कि परमाणु के भीतर मौजूद नाभिक के बाहृ भाग में अलग-अलग स्तर (कक्षा या कक्ष) सृजित हुए होते हैं, जिनमे इलेक्ट्रॉन वृत्ताकार गति करते हैं। इन अलग-अलग स्तरों पर ऊर्जा का स्तर भी भिन्न होता है अर्थात् जो स्तर या कक्ष नाभिक के ज्यादा पास होगा, उसमे उतनी ही काम ऊर्जा होगी। जैसे-जैसे इन कक्षों की स्थिति नाभिक से दूर होती जाती है, वैसे-वैसे इनमे ऊर्जा का स्तर बढ़ता जाता है। परमाणु में किसी कारण से यदि ऊर्जा में बदलाव होता है, तो इलेक्ट्रॉन द्वारा भी कक्षों या ऊर्जा स्तरों में बदलाव होने लगता है। जब परमाणु के भीतर इलेक्ट्रॉन अपने एक ही कक्ष में स्थायी रूप से गतिमान रहता है तो इसे आद्य अवस्था कहते है।
जब ऊर्जा स्तर में बदलाव के कारण इलेक्ट्रॉन एक कक्ष की त्यागकर दूसरे कक्ष में पहुँच जाता है तो इसे इलेक्ट्रॉन की उत्तेजित अवस्था कहा जाता है। इलेक्ट्रॉन द्वारा गति करते वक्त इन कक्षों के कारण ऊर्जा का निर्धारण होता है, जिससे इलेक्ट्रॉन में तीव्रता पैदा होती है। इसी वजह से विकिरण को उत्सर्जित नही कर पाते। इस बिंदु ने रदरफोर्ड के मॉडल की कमी को दूर कर दिया, क्योंकि यहाँ यह बात सिद्ध हुई कि विकिरण का उत्सर्जन न होने के कारण इलेक्ट्रॉन नाभिक के भीतर नही गिर सकते।
बोर का परमाणु मॉडल कमियाँ
- परमाणु में इलेक्ट्रॉन द्वारा गतिशील रहने के दौरान उनमे मौजूद ऊर्जा का स्तर कम व ज्यादा होता है। इससे इलेक्ट्रॉन द्वारा अपने कक्षों में भी बदलाव किया जाता है। इस कारण स्पेक्ट्रम रेखाओं का सृजन होता है।
- चुम्बकीय प्रभाव वाले क्षेत्र में इन स्पेक्ट्रम रेखाओं में विभाजित होता है, इससे पड़ने वाला प्रभाव “ज़ीमान प्रभाव” कहलाता है।
- विद्युत प्रभावी क्षेत्र में स्पेक्ट्रम रेखाओं में विभाजन होने की क्रिया से पड़ने वाले प्रभाव को “स्टॉर्क प्रभाव” कहते हैं।
- बोर द्वारा प्रस्तुत किये गए मॉडल में ज़ीमान प्रभाव व स्टॉर्क प्रभाव दोनों का स्पष्टीकरण नही किया गया।
थॉमसन का परमाणु मॉडल | Thomson Ka Parmanu Model
परमाणु की संरचना को समझाने के लिए वैज्ञानिक थॉमसन ने प्लम पुडिंग मॉडल दिया था। फिल्म पुडिंग मॉडल के अनुसार परमाणु का धनावेश एक तरबूज की तरह होता है जिसमें इलेक्ट्रॉन बीज की तरह फंसे रहते हैं। परंतु यह परमाणु मॉडल असफल हो गया क्योंकि यह परमाणु की विशेषताओं को नहीं बता पाया। इसके पश्चात पर रदरफोर्ड ने अपना परमाणु मॉडल दिया था।
सन 1891-1897 तक के अपने प्रयोगो द्वारा सन 1898 में जे.जे. थॉमसन ने यह बताया की परमाणु एक समान आवेशित गोला (त्रिज्या लगभग 10−10m) होता है, जिसमे धनावेश बराबर रूप से वितरित रहता है। इस पर इलेक्ट्रॉन इस प्रकार लगे होते हैं कि उससे एक स्थिर व स्थायी वैद्युत व्यवस्था प्राप्त होती है। इसे इलेक्ट्रॉन की खोज के तुरंत ही बाद, और परमाणु नाभिक की खोज से पहले बनाया गया था। इस प्रस्तावित मॉडल को थॉमसन ने मार्च 1904 में उस समय की प्रतिष्ठित वैज्ञानिक पत्रिका ‘फिलॉस्फिकल मैग्जीन‘ में प्रकाशित कराया था।
इस परमाणु मॉडल को कई नाम दिए गए है जैसे:- प्लम-पुडिंग मॉडल (Plum-pudding model), रेज़िन-पुडिंग मॉडल, तरबूज मॉडल आदि। इस मॉडल का नाम तरबूज मॉडल इसलिए रखा गया क्योंकि इस मॉडल में परमाणु का धनावेश या तरबूज जैसा माना गया है और इलेक्ट्रॉन इसमे प्लम अथवा बीज की तरह मौजूद है।
इस मॉडल की ख़ास बात यह है कि इसमे परमाणु का द्रव्यमान पूरे परमाणु पर समान रूप से बंटा हुआ माना गया है। परन्तु यह मॉडल भविष्य के परमाणु के प्रयोगो के संगत नहीं पाया गया। यह परमाणु मॉडल रदरफोर्ड के प्रकीर्णन को नहीं समझा सका। इसलिए इसे रद्द कर दिया गया। यह मॉडल परमाणु की विद्युत उदासीनता को पूर्णतया स्पष्ट करता था। थॉमसन को सन 1906 में भौतिकी में गैसों की विद्युत चालकता पर सैद्धान्तिक व प्रायोगिक जांच के लिए नोबेल पुरस्कार से सम्मानित किया गया था। इस परमाणु मॉडल के सिद्धान्त का खंडन अर्नेस्ट रदरफोर्ड ने अपने सन 1911-1919 तक के परमाणु मॉडल के प्रयोगो के आधार पर किया।
थॉमसन के परमाणु मॉडल की कमियाँ
थॉमसन के मॉडल के बाद दूसरे वैज्ञानिकों द्वारा परमाणु के सम्बन्ध में और नए प्रयोग व खोज करने से दूसरे तथ्य प्रस्तुत किये गए। इस कारण से थॉमसन के मॉडल की बहुत सी कमियाँ सामने आईं, जिनमें से कुछ हैं-
- थॉमसन ने परमाणु के मध्य भाग में उपस्थित नाभिक या केन्द्रक की मौजूदगी के सम्बन्ध में न कोई व्याख्या की गयी थी और न कोई जानकारी दी थी गयी।
- परमाणु में उपस्थित उदासीन प्रवृति के कण न्यूट्रॉन के अस्तित्व का भी उल्लेख नही किया गया था, अपितु यह कहा गया कि परमाणु स्वयं आवेश विहीन होता है।
- थॉमसन ने बताया की तरबूज में मौजूद बीजों की भाँति परमाणु के धनावेश युक्त कण (प्रोटॉन) व इलेक्ट्रॉन भी बिखरे हुए रहते हैं। इलेक्ट्रॉन की सही स्थिति की व्याख्या नही की थी। जबकि बाद में हुए नए प्रयोगों व शोधों के आधार पर दूसरे विज्ञान विशेषज्ञों द्वारा यह तथ्य पेश किये गए कि प्रोटॉन नाभिक के अंदर की ओर स्थित रहते हैं और इलेक्ट्रॉन नाभिक के बाहर चारों ओर गति करते रहते हैं।
- प्रोटॉन व इलेक्ट्रॉन के क्रमशः धनावेश व ऋणावेश से युक्त होने पर तथा साम्यता के साथ एक-दूसरे के आसपास स्थित होने पर ये दोनों विपरीत होने के कारण एक-दूसरे को आकर्षित करके आपस में टकराकर खुद ही नष्ट हो जाएगे। इस कारण परमाणु में विद्युत आवेश नही होगा। थॉमसन द्वारा रखे गए इस पहलू द्वारा भी सत्यता प्रमाणित नही हुई थी।
परमाणु संख्या, परमाणु संख्या किसे कहते हैं | Parmanu Sankhya, Parmanu Sankhya Kya Hai
किसी परमाणु के नाभिक में प्रोटॉन की संख्या को ही परमाणु क्रमांक (Atomic number) कहा जाता है। आपकी बेहतर जानकारी के लिए बता दे की परमाणु संख्या बस है प्रोटॉन की संख्या में एक परमाणु. इस कारण से, इसे कभी-कभी प्रोटॉन संख्या भी कहा जाता है।
ध्यान रहे की एक रासायनिक तत्व के परमाणु संख्या या प्रोटॉन संख्या (Z) परमाणु के नाभिक में पाए जाने वाले प्रोटॉन की संख्या है। यह नाभिक की चार्ज संख्या के समान है।
परमाणु संख्या विशिष्ट रूप से रासायनिक तत्व की पहचान करती है। एक निर्वहन परमाणु में, परमाणु संख्या इलेक्ट्रॉनों की संख्या के बराबर होती है।
परमाणु संख्या (Z) = परमाणु के नाभिक में प्रोटॉनों की संख्या = उदासीन परमाणु में इलेक्ट्रॉनों की संख्या
द्रव्यमान संख्या
परमाणु में उपस्थित प्रोटॉनों एवं न्यूट्रॉनों के सम्मिलित संख्या को द्रव्यमान संख्या कहते हैं।
द्रव्यमान संख्या (A) = प्रोटॉनों की संख्या (2) + न्यूटॉनों की संख्या (n)
परमाणु भार
परमाणु अत्यंत छोटा कण है। इसके द्रव्यमान को ज्ञात करना अत्यंत कठिन है। परंतु वर्तमान समय में द्रव्यमान स्पेक्ट्रोमीटर उपकरण की सहायता से परमाणु भार ज्ञात कर सकते हैं। परमाणु भार को अनेक विधियों से ज्ञात किया जाता है। परंतु आधुनिक अवधारणा से कार्बन 12 से परिभाषित किया गया।
किसी तत्व का परमाणु भार वह संख्या है। जिसमें परमाणुओं की संख्या उतनी होती है। जितनी कार्बन 12 के एक परमाणु में 12वें भाग से जितना गुना भारी होती है।
परमाणु भार = [तत्व के एक परमाणु का भार/कार्बन 12 के एक परमाणु का भार]× 1/12
परमाणु भार एक आपेक्षिक संख्या है। इसकी कोई इकाई नहीं होती है। परंतु A.M.U. (Atomic mass per unit) इकाई लिखते हैं। वर्तमान समय में amu के स्थान पर U (Unified mass) का प्रयोग करते हैं।
सभी तत्वों के परमाणु भार ज्ञात करना बहुत कठिन है। क्योंकि समस्थानिको के कारण परमाणु भारो में परिवर्तन हो जाता है।
अणु भार
किसी पदार्थ का अणुभार वह संख्या है। जिसमें उतने ही कण उपस्थित होते है। जितने कार्बन 12 के 12 वे भार से अधिक भारी होता है।
अणु भार = [पदार्थ के एक अणु भार/कार्बन 12 के एक परमाणु भार] ×1/12
तुल्यांकी भार
तुल्यांकी भार वह संख्या है। जो यह प्रदर्शित करती है की यह हाईड्रोजन के 1.008 भाग ऑक्सीजन के 8 भाग या क्लोरीन के 35.5 भाग या सिल्वर के 108 भार भाग से प्रत्येक या परोक्ष रूप से संयोग करते है। अथवा यौगिक में से विस्थापित करते है। उसे तुल्यांकि भार कहते है।
तुल्यांकी भार एक शुद्ध संख्या है। इसे निम्न प्रकार से ज्ञात कर सकते है।
किसी परमाणु भार का तुल्यांकी भार = परमाणु भार/परमाणु की संयोजकता
अम्ल का तुल्यांकी भार = अम्ल का अणु भार/H+ आयनों की संख्या
क्षार का तुल्यांकी भार = क्षार का अणु भार/OH– आयनों की संख्या
किसी यौगिक का तुल्यांकी भार = यौगिक का अणु भार/धनायन व ऋण आयन की संख्या
1 से 40 तक परमाणु क्रमांक, परमाणु क्रमांक 1 से 30 तक | Parmanu Kramank 1 to 50
आवर्त सारणी के अंतर्गत अलग-अलग परमाणुओं की परमाणु संख्या अलग-अलग होती है, कौन से परमाणु की परमाणु संख्या कितनी है, इसके बारे में विस्तार से जानकारी आपको नीचे दी गई सारणी में उपलब्ध करवाई गई है:-
परमाणु ऊर्जा क्या है | Parmanu Urja Kya Hai
परमाणु ऊर्जा परमाणु प्रतिक्रियाओं द्वारा जारी की जाती है। यह प्रतिक्रिया या तो विखंडन या संलयन द्वारा हो सकती है। परमाणु संलयन में, प्रतिक्रिया परमाणु एक साथ मिलकर एक बड़ा परमाणु बनाते हैं। परमाणु विखंडन में, परमाणु विभाजित होकर ऊर्जा मुक्त करके छोटे परमाणु बनाते हैं। परमाणु ऊर्जा संयंत्र परमाणु विखंडन का उपयोग करके ऊर्जा देते हैं। परमाणु ऊर्जा का विमोचन या अवशोषण आमतौर पर परमाणु प्रतिक्रियाओं या रेडियोधर्मी क्षय में होता है।
यह ध्यान दिया जाना चाहिए कि जो ऊर्जा को अवशोषित करते हैं वे एंडोथर्मिक प्रतिक्रियाएं हैं और जो ऊर्जा छोड़ते हैं वे एक्सोथर्मिक प्रतिक्रियाएं हैं। किसी प्रतिक्रिया में ऊर्जा की खपत या मुक्ति परमाणु बंधन ऊर्जा में अंतर के कारण होती है। यह ऊर्जा परमाणु रूपांतरण के आने वाले और बाहर जाने वाले उत्पादों के बीच मौजूद होती है।
ऊष्माक्षेपी परमाणु रूपांतरण के ज्ञात वर्ग विखंडन और संलयन हैं। परमाणु ऊर्जा को परमाणु विखंडन द्वारा मुक्त किया जा सकता है जब यूरेनियम और प्लूटोनियम जैसे भारी परमाणु नाभिक हल्के नाभिक में टूट जाते हैं। विखंडन से प्राप्त ऊर्जा का उपयोग दुनिया भर में सैकड़ों स्थानों पर विद्युत उत्पादन के लिए किया जाता है। परमाणु संलयन के दौरान परमाणु ऊर्जा भी निकलती है।
उदाहरण के लिए, जब हल्के नाभिक, हाइड्रोजन संयुक्त होकर हीलियम जैसे भारी नाभिक बनाते हैं। सूर्य और अन्य तारे तापीय ऊर्जा उत्पन्न करने के लिए परमाणु संलयन का उपयोग करते हैं। यह ऊर्जा सतह से विकिरित होती है। यह एक प्रकार का तारकीय न्यूक्लियोसिंथेसिस है। किसी भी ऊष्माक्षेपी परमाणु प्रक्रिया में, परमाणु द्रव्यमान को तापीय ऊर्जा में परिवर्तित किया जाता है जो ऊष्मा के रूप में निकलती है।
- परमाणु ऊर्जा के अनुप्रयोग
- परमाणु प्रौद्योगिकी
- नाभिकीय औषधि
- परमाणु प्रौद्योगिकी का कृषि उपयोग
- परमाणु प्रौद्योगिकी उद्योगों में उपयोगी है
- परमाणु प्रौद्योगिकी का पर्यावरणीय उपयोग
- जैविक प्रयोग
- चिकित्सा निदान और उपचार
- वैज्ञानिक जांच
- इंजीनियरिंग परियोजनाएँ
- न्यूट्रॉन सक्रियण विश्लेषण
परमाणु ऊर्जा के लाभ
परमाणु ऊर्जा हमारे ऊर्जा ग्रिड के उत्सर्जन-मुक्त वर्कहॉर्स के रूप में कई लाभ देती है। परमाणु ऊर्जा का अद्वितीय मूल्य ऊर्जा के किसी अन्य स्रोत में नहीं पाया जा सकता है।
1) परमाणु राष्ट्रीय सुरक्षा की रक्षा करता है। परमाणु ऊर्जा में अमेरिकी नेतृत्व वैश्विक स्तर पर सुरक्षा और अप्रसार मानकों को बनाए रखता है। यह घर पर एक लचीले विद्युत ग्रिड का समर्थन करता है और एक मजबूत नौसेना को ईंधन देता है।
2) परमाणु जलवायु परिवर्तन से लड़ता है। परमाणु ऊर्जा बड़ी मात्रा में 24/7 कार्बन-मुक्त बिजली देती है। यह ऊर्जा पर्यावरण की रक्षा में अपूरणीय है।
3) परमाणु प्रौद्योगिकी में अमेरिकी नेतृत्व सुनिश्चित करता है। संयुक्त राज्य अमेरिका ने दुनिया के लिए परमाणु ऊर्जा की शुरुआत की। संयुक्त राज्य अमेरिका ने नेतृत्व जारी रखा है और उन्नत रिएक्टरों के साथ दुनिया भर में बढ़ती स्वच्छ ऊर्जा की मांग का जवाब दे सकता है।
4) परमाणु विश्वसनीय रूप से बिजली पैदा करता है। 21वीं सदी में परमाणु ऊर्जा को समृद्ध करने के लिए हमारे देश के लिए चौबीसों घंटे बिजली जरूरी है। स्वच्छ और विश्वसनीय परमाणु ऊर्जा अमेरिकी बुनियादी ढांचे का एक प्रमुख हिस्सा है जैसे कि यह एक समय में 18 महीने से 24 महीने तक बिना रुके चलती है।
5) परमाणु रोजगार पैदा करता है। परमाणु ऊर्जा 100,000 से अधिक अच्छी तनख्वाह वाली, दीर्घकालिक नौकरियाँ (रोज़गार) प्रदान करती है। यह राज्य और स्थानीय कर राजस्व में लाखों डॉलर के साथ स्थानीय अर्थव्यवस्थाओं का समर्थन करता है।
6) इसके अलावा, परमाणु हमारी हवा की रक्षा करता है। नाइट्रोजन ऑक्साइड, सल्फर डाइऑक्साइड, पार्टिकुलेट मैटर और पारा, ये सभी रसायन ऐसे हैं जो हम जिस हवा में सांस लेते हैं उसमें नहीं होना चाहिए। परमाणु ऊर्जा इन प्रदूषकों के किसी भी निशान के बिना चौबीसों घंटे बिजली प्रदान करती है।
7) परमाणु अंतर्राष्ट्रीय विकास को बढ़ावा देता है। साथ ही, परमाणु ऊर्जा विकासशील देशों को सतत विकास के लक्ष्यों को पूरा करने में मदद करती है।
8) परमाणु ऊर्जा से चलने वाले इलेक्ट्रिक वाहन। कार्बन उत्सर्जन को कम करने के लिए विद्युतीकृत परिवहन राज्य। इलेक्ट्रिक वाहन कार्बन मुक्त परमाणु ऊर्जा द्वारा संचालित होते हैं, इलेक्ट्रिक वाहन अपनी पूरी क्षमता तक पहुंच सकते हैं। ये इलेक्ट्रिक वाहन पर्यावरण को ज्यादा नुकसान नहीं पहुंचाते हैं.
9) परमाणु ऊर्जा के लाभ कार्बन-मुक्त बिजली से भी कहीं अधिक हैं। परमाणु ऊर्जा अंतरिक्ष अन्वेषण चिकित्सा उपकरणों को निष्फल करता है, अलवणीकरण के माध्यम से पीने योग्य पानी देता है और कैंसर के इलाज के लिए रेडियोआइसोटोप की आपूर्ति भी करता है और भी बहुत कुछ।
परमाणु ऊर्जा के नुकसान
- नवीकरणीय ऊर्जा के लिए परमाणु एक ख़राब मेल है। नवीकरणीय वस्तुएं तब सबसे अच्छा काम करती हैं जब उन्हें लचीली प्रौद्योगिकियों के साथ जोड़ा जाता है। ऐसा तभी होता है जब वे ठंड, रातों जैसे महत्वपूर्ण समय पर तनाव उठा सकते हैं। आप, परमाणु ऊर्जा स्टेशन अत्यधिक लचीले होते हैं जैसे कि उन्हें ऊपर या नीचे करना बहुत मुश्किल होता है। यही कारण है कि ये स्टेशन उस ग्रिड के लिए उपयुक्त नहीं हैं जिसमें बहुत अधिक नवीकरणीय ऊर्जा है।
- परमाणु ऊर्जा स्टेशन बनाना बहुत महंगा है। नई परमाणु ऊर्जा तटवर्ती पवन और अन्य बड़े पैमाने के सौर स्टेशनों की तुलना में अधिक महंगी है। आप, परमाणु दिन-ब-दिन महंगा होता जा रहा है।
- परमाणु ऊर्जा स्टेशनों के निर्माण के अलावा भी बड़ी लागतें हैं। किसी परमाणु संयंत्र को बंद करना और उसके कचरे का निपटान करना जटिल, खतरनाक और महंगा है।
- परमाणु ऊर्जा स्टेशनों की योजना और निर्माण में बहुत समय लगता है। एक परमाणु ऊर्जा स्टेशन के निर्माण और उसकी मंजूरी में लगभग 10 से 20 साल का समय लगता है। चीजें योजना के अनुसार होती हैं और चूंकि वे इतनी जटिल होती हैं, इसलिए परियोजनाओं में अक्सर लंबी देरी होती है। अन्य प्रौद्योगिकियों का निर्माण परमाणु ऊर्जा स्टेशनों की तुलना में बहुत तेजी से किया जा सकता है।
- परमाणु ऊर्जा हमें कम संख्या में साइटों पर निर्भर बनाती है। सभी बिजली स्टेशनों में कभी-कभी कटौती का अनुभव होता है। चूँकि परमाणु ऊर्जा स्टेशन भारी मात्रा में बिजली उत्पन्न करते हैं, यदि कोई परमाणु ऊर्जा स्टेशन ऑफ़लाइन हो जाता है तो यह ग्रिड पर भारी दबाव डालता है।
- परमाणु से कुछ लोगों को लाभ होता है, बहुतों को नहीं। परमाणु ऊर्जा स्टेशन बनाने के लिए जिस स्तर की विशेषज्ञता और पूंजी की आवश्यकता होती है। इसका मतलब यह है कि बहुत कम लोग ही इसे बनाने में सक्षम हैं।
- परमाणु विकिरण दुर्घटनाएँ। स्टेशनों से निकलने वाला रेडियोधर्मी कचरा प्रकृति और मनुष्यों के लिए हानिकारक है।
बिजनेस, जॉब या कमाई से जुड़े अन्य आइडियाज हिंदी में पढ़ने के लिए यहां क्लिक करें।FAQ | परमाणु | Parmanu
Q1. परमाणु क्रमांक किसे कहते हैं
Ans – परमाणु क्रमांक और परमाणु संख्या दोनों एक ही होते हैं. प्रत्येक तत्व के नाभिक में प्रोटान उपस्थित होते हैं और यही प्रोटानों की संख्या ही परमाणु की संख्या कहलाती है। परमाणु संख्या z = इलेक्ट्रान = प्रोटान
Q2. परमाणु कितने प्रकार के होते हैं
Ans – परमाणु तीन प्रकार के होते हैं – इलेक्ट्रॉन, प्रोटोन, न्यूट्रॉन ।
Q3. परमाणु भार किसे कहते हैं
Ans – किसी तत्व का परमाणु द्रव्यमान यानि परमाणु भार वह संख्या है जो यह प्रदर्शित करता है कि उस तत्व का एक परमाणु, कार्बन-12 के एक परमाणु के 1/12 वें भाग से कितना गुना भारी है।
Q4. परमाणु त्रिज्या किसे कहते हैं
Ans – किसी परमाणु के नाभिक केन्द्र से उसके बाहरी इलेक्ट्रॉन कक्ष के बीच की दूरी को परमाणु त्रिज्या (Atomic Radius) कहते है। सामान्यत: परमाणु त्रिज्या आवर्त में बायीं ओर से दाहिने ओर घटते जाते हैं, जिसका सबसे प्रमुख उदाहरण लिथियम बायीं ओर होता है, क्योंकि इसका परमाणु भार अधिक होता है। वहीँ दूसरी तरफ सबसे कम परमाणु भार होने के कारण दायीं तरफ Neon होता है। परमाणु त्रिज्या नाभिक के केंद्र से इलेक्ट्रॉनों वाले सबसे बाहरी खोल की दूरी है। दूसरे शब्दों में, यह नाभिक के केंद्र से उस बिंदु तक की दूरी है जहाँ तक इलेक्ट्रॉन बादल का घनत्व अधिकतम होता है।
Q5. परमाणु संख्या किसे कहते हैं
Ans – किसी परमाणु के नाभिक में उपस्थित प्रोटॉनों की कुल संख्या को परमाणु संख्या कहते हैं ।
भारत में नौकरी और व्यवसाय से संबंधित अधिक लेख पढ़ने के लिए, यहां क्लिक करें।
क्या आप सरकारी नौकरियों की तलाश कर रहे हैं, नवीनतम नौकरियों की जांच करें लिंक पर क्लिक करें। एचआर से संबंधित अद्यतनों पर नवीनतम लेख के बारे में जानने के लिए, यहां क्लिक करें। यदि आप बंगाल में विभिन्न विषयों पर प्रश्न उत्तर पढ़ने के इच्छुक हैं, तो यहां क्लिक करें। इसके अलावा, अगर आप स्वास्थ्य, सौंदर्य, वित्त, वित्तीय, व्यापार या ट्रेंडिंग टेक्नोलॉजी पर नवीनतम समाचार पढ़ने में रुचि रखते हैं, तो यहां क्लिक करें।




